| |
Заведующая – Е.С. Надеждина
Группа клеточной биологии внесла значительный вклад в изучение структуры, функции и регуляции активности белка кинезина-1. Кинезин-1 – это стимулируемая микротрубочками АТФаза, которая способна перемещаться от минус- к плюс-концу микротрубочек, т.е. от центра клетки к ее периферии, или по антероградному пути. При этом кинезин-1 может переносить связанные с ним карго – субклеточные частицы и органеллы. В работах сотрудников группы клеточной биологии было показано (слайд CBG1a, 1), что, в частности, кинезин-1 переносит пигментные гранулы в меланофорах, а также способствует равномерному распределению по фибробластам виментиновых промежуточных филаментов, «растаскивая» их из околоядерного скопления к краям клеток.
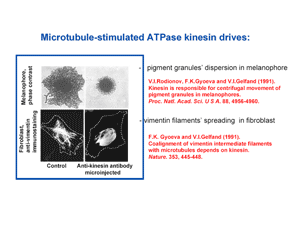
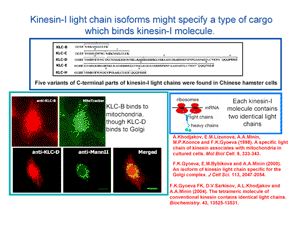
Молекула кинезина-1 состоит из двух тяжелых цепей, несущих АТФазный домен, и двух легких, участвующими во взаимодействии кинезина с его карго. В работах сотрудников группы клеточной биологии были клонированы кДНК легких цепей кинезина-1 из клеток CHO (фибробласты яичника китайского хомячка), и оказалось, что легкие цепи имеют вариабельную С-концевую часть. (слайд CBG1a, 2). Всего было идентифицировано 5 вариантов (изоформ) легких цепей кинезина-1. Было показано, что в молекуле кинезина-1 содержатся всегда две идентичных легких цепи, или же иногда легких цепей нет. Кинезин-1, содержащий изоформу легких цепей KLC-B специфично связывается с митохондриями, а изоформу KLC-D – с цистернами аппарата Гольджи, т.е. изоформы легких цепей обуславливают специфичность взаимодействия кинезина-1 с его карго.
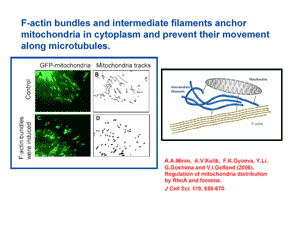
Митохондрии активно перемещаются по клетке, и их движение зависит от кинезина-1. Однако при некоторых воздействиях на клетку митохондрии становятся неподвижными. В работах сотрудников группы клеточной биологии показано, что переход митохондлрий к неподвижному состоянию связан с формированием пучков актиновых филаментов. В связывании митохондрий с актиновыми филаментами участвуют также и виментиновые промежуточные филаменты – в отсутствие этих филаментов подвижность митохондрий теряет способность к регуляции (слайд CBG2a).
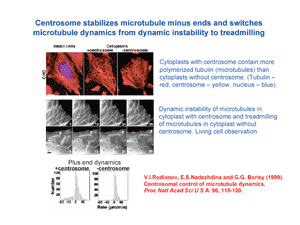
Микротрубочки клеток, полимеры белка тубулина, очень динамичны. Они постоянно растут, разбираются, растут вновь, и в клетках их система сохраняет радиальное строение с центром в центросоме. Различают динамическую нестабильность микротрубочек, когда их рост и разборка, чередуясь, происходят на плюс-конце, у края клетки, и тредмиллинг микротрубочек, когда рост происходит на плюс-конце, а разборка – на минус-конце. В работе группы клеточной биологии показано, что в присутствии в клетках центросомы превалирует динамическая нестабильность микротрубочек, но в отсутствие центросомы динамика микротрубочек переключается на тредмиллинг (слайд CBG3a, 1). Это сопровождается снижением количества полимеризованного тубулина. Таким образом, показана роль центросомы в стабилизации минус-концов микротрубочек, что переключает динамику клеточных микротрубочек на динамическую нестабильность.
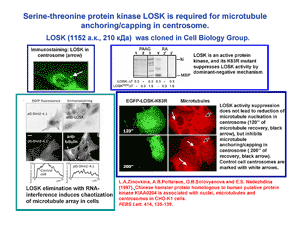
В работах группы клеточной биологии была клонирована новая серин-треониновая протеинкиназа млекопитающих LOSK (Long Ste20-like Kinase). Эта киназа принадлежит к семейству Ste20-подобных протеинкиназ. Функции Ste20-подобных протеинкиназ в клетках остаются непонятными, предполагают их участие в МАР-киназных каскадах в качестве киназ киназ киназ митоген-активируемых киназ (МАРКККK). В работах группы показано, что LOSK частично ассоциирован с микротрубочками и центросомой. Это конститутивно активная киназа гистонового типа, не имеющая в своей молекуле известных регуляторных доменов. При подавлении активности LOSK при синтезе в клетках доминантно-негативного мутанта, происходит подавление способности центросомы связывать и стабилизировать минус-концы микротрубочек, хотя способность центросомы нуклеировать микротрубочки сохраняется (слайд CBG3a, 2). Аналогично действует и подавление синтеза LOSK в клетках методом РНК-интерференции.
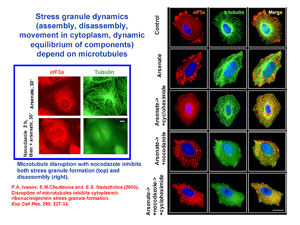
Наконец, в работах группы клеточной биологии показано, что формирование в клетках стрессовых гранул – РНП-комплексов, возникающих в ответ на стресс, в частности, при обработке клеток арсенатом, зависит от микротрубочек. При разрушении микротрубочек стрессовые гранулы не образуются, а разрушение актиновых филаментов на них не влияет (слайд CBG4a). Показано также, что от микротрубочек зависит и разборка гранул при действии циклогексимида. Стрессовые гранулы способны перемещаться по клетке, и их движение подавляется при разрушении микротрубочек. Компоненты стрессовых гранул обмениваются с цитоплазмой, и этот обмен также значительно замедляется после разборки микротрубочек. Таким образом, микротрубочки необходимы для пространственного перемещения компонентов стрессовых гранул (полиА-связывающего белка, фактора eIF3, белка TIA-1).
|
|
